قانون بويل
روبرت بويل
روبرت وليام بويل، هو فيلسوف طبيعي كيميائي وفيزيائي ومخترع، ولد في لايمور بمقاطعة تُدعى ترفورد في أيرلندا، وهو الابن الرابع عشر لإيرل كورك الأوّل في أيرلندا، ويعتبر من أهم الأشخاص العاملين في مجال الغازات وخواصّها؛ لأنّه أسهم بشكلٍ كبير في تأسيس الكيمياء والمفاهيم المتعلّقة بالغازات بمعناها الحديث والمتطوّر، وهو أحد أهم روّاد الطريقة التجريبيّة العلميّة الحديثة.
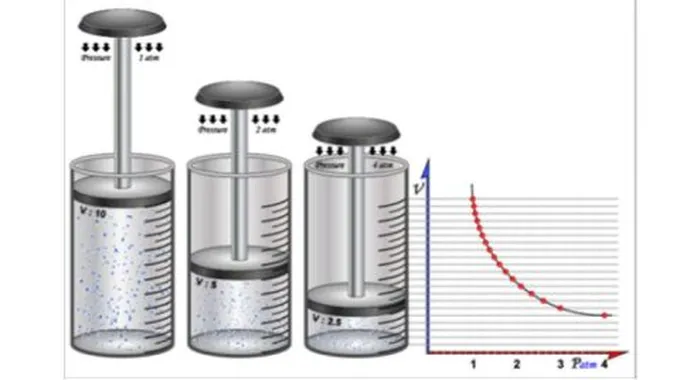
استطاع بويل في عام 1657 للميلاد تطوير مضخّة هوائيّة، وقام بدراسة العلاقة العكسيّة بين الحجوم والضغوط للغازات المختلفة مع ثبوت درجة الحرارة في نظام مغلق، ممّا أدَّى إلى اكتشافه قانوناً عُرف باسمه، ويعتبر هذا القانون من أهمّ الأعمال والقوانين التي قام بصياغتها في المجال الكيميائي، ولمزيد من المعلومات عن قانون بويل إليكم هذا المقال.
قانون بويل
قانون بويل هو واحد من قوانين الغازات التي تمَّ اشتقاق قانون الغاز المثالي بناء عليها، حيث قام العالم بويل بتثبيت درجة حرارة الغاز "د"، ثمَّ قام بقياس حجم الغاز "ح" عند تغيير قيم ضغطه "ض"، واكتشف أنّ هناك علاقة تناسب عكسي بين الضغط والحجم، حيث يزداد حجم الغاز بنقصان الضغط المؤثّر عليه، ويقلّ حجم الغاز بزيادة الضغط الذي يؤثّر عليه، وبأسلوب آخر عبَّر عن القانون كما يأتي : إذا زاد الضغط قلّ الحجم بنفس النسبة، وكلّما زاد الحجم قلّ الضغط، عند الاحتفاظ بدرجة حرارة ثابتة، ممّا أدَّى إلى صياغة العلاقة الرياضيّة الآتية: ح = 1 / ض
نص قانون بويل
بثبوت درجة الحرارة، عندما يتغيّر ضغط كمّية معيّنة من غاز ما، فإنّ الحجم يتناسب عكسيّاً مع تغيّر الضغط، وبصيغة رياضيّة يُمكن التعبير عن القانون كما يأتي :
ح ض = ث
حيث:
ض: ضغط الغاز، ويقاس بعدّة وحدات أهمّها (مم زئبق، أو بار، أو باسكال).
ح: حجم الغاز، ويُقاس بعدّة وحدات منها (اللتر، أو السنتيمتر مكعّب، أو ديسيلتر وغيرها).
ث: ثابت.
اشتقاق قانون بويل
يتناسب حجم الغاز المحصور عكسيّاً مع الضغط الواقع عليه.
ض α 1 / ح
وبتحويل التناسب إلى علاقة مساواة ينتج الشكل الآتي:
ض = ثابت × ( 1 / ح )
وبترتيب العلاقة السابقة:
ض × ح = ثابت
وعندما يكون لدينا ظرفان مختلفان للغاز عند ثبوت درجة الحرارة فإن :
ض1 × ح1 = ثابت
ض2 × ح2 = ثابت
وبمساواة الطرفين فإنّ :
ض1 × ح1 = ض2 × ح2
وعند تطبيق قانون بويل يجب أن تتجانس وحدات الحجم والضغط علماً أنّ ( 1 ضغط جوي = 760 مم زئبق ) و ( 1 لتر = 1000 سم3 ).
مثال توضيحي:تشغل كتلة من غاز الأوكسجين حجماً مقداره 40 سم3 عند 1000 ضغط جوي، احسب حجمه عند ضغط 0.8 ضغط جوّي، مع العلم أنّ درجة حرارته ثابتة.
الحل : ض1 × ح1 = ض2 × ح2
1 × 40 = 0.8 × ح2
40 / 0.8 = ح2
ح2 = 50 سم3.