تعريف عدد أفوجادرو
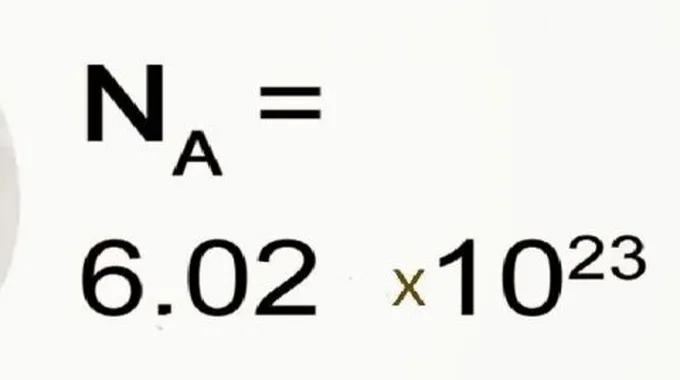
العالم أفوجادرو
هو عالم فيزيائي إيطالي يُدعى أميديو أفوجادرو، ولد في مدينة تورين، وعمل بجامعة تورينو، وتعتبر النظرية الجزيئيّة واحدة من أهم أعماله، كما طرح فرضيته المشهورة التي تدعى قانون أفوجادرو عام 1811م، وساهم في تطوير العلوم الخاصّة بالغازات ودراسة ماهيتها.[1]
عدد أفوجادرو
عدد أفوجادرو يُطلق عليه أيضاً اسم ثابت أفوجادرو، هو أحد الثوابت المستخدمة في علم الكيمياء والفيزياء، وسمّى بهذا الاسم نسبةً للعالم الذي أوجده. ويمثّل عدد أفوجادرو عدد ذرّات الكربون -12 في 12 غرام من الكربون -12، والذي يعادل العدد 6.022×1023 تقريباً. وتمّ اختيار عنصر الكربون -12 لحساب العدد لأنّه يمكن قياس كتلته بشكلٍ دقيق، حيث إنّ وزن المول الواحد من عنصر الكربون -12 المُقاس باستخدام مقياس الكلتة الموليّة الافتراضي هو 12.000 وقد تمّ الحصول على هذا العدد عن طريق تقسيم كتلة الذّرة الحقيقيّة على واحدة قياسيّة للكتل الذريّة.[2]
تمّ ابتكار عدد أفوجادرو لأنّ عمليّة التعامل مع الذرّات صغيرة الحجم عمليةً صعبةً جداً ومن الممكن أن تكون مستحيلة، فالذّرات لا ترى بالعين المجردّة أو المجاهر العلميّة، لذلك يُصعب دراستها باستخدام المقاييس العاديّة، لذلك تمّ التفكير في التعامل مع عدد معين من الذرات الخاصّة بعنصر محدد لتسهيل حساب كميّات الذرّات.[2]
علاقة المول بعدد أفوجادرو
إنّ المول هو وحدة لقياس كميّة المادّة في علم الكيمياء، وتعتبر وحدة أساسية حسب النظام العالمي للوحدات، وهي واحدة من الوحدات المستخدمة لقياس كميّة فيزيائيّة، ويعرف المول أيضاً بأنّه الكتلة الذريّة أو الجزيئيّة للمادّة ويمكن التعبير عنه بالغرام، كما يعبّر عن كميّة المادّة التي تحتوي على نفس عدد الجسميات الموجودة في غرام واحد من عنصر الكربون، وفي حالة ذكر المول يجب التفريق ما إذا كان نوع جسميات المادّة ذرّات، أو جزيئات، فإذا كانت ذرّات نقوم بحسابها باستخدام العدد الذرّي، وإذا كانت جزيئات نحسب المول باستخدام الوزن الجزيئي.[3]
هناك علاقة وثيقة بين المول وعدد أفوجادرو، حيث إنّ عدد الذّرات أو الجزيئات التي توجد في 1 مول من المادّة يساوي عدد أفوجادرو. فعلى سبيل المثال إنّ 1 مول من عنصر الألمونيوم فيه عدد ذرّات كما في 1 مول من عنصر الكربون، وتمّ تحديد عنصر الكربون لأنّه العنصر المعتمد في تحديد عدد أفوجادرو.[3]
يمكن حساب كميّة المادّة رياضياً باستخدام الخطوات التالية:[3]
- حساب عدد المولات وهو يساوي مقدار الكتلة مقسوماً على الكتلة المولية.
- حساب كميّة المادّة وهي تساوي عدد المولات مقسوماً على عدد الجزيئات.
المراجع
- ↑ "Amedeo Avogadro", www.famousscientists.org, Retrieved 13-7-2018. Edited.
- ^ أ ب JONATHAN ATTEBERRY, "What is Avogadro’s number?"، science.howstuffworks.com, Retrieved 13-7-2018. Edited.
- ^ أ ب ت "The Mole and Avogadro's Constant", chem.libretexts.org, Retrieved 13-7-2018. Edited.