عناصر المجموعة الثانية في الجدول الدوري
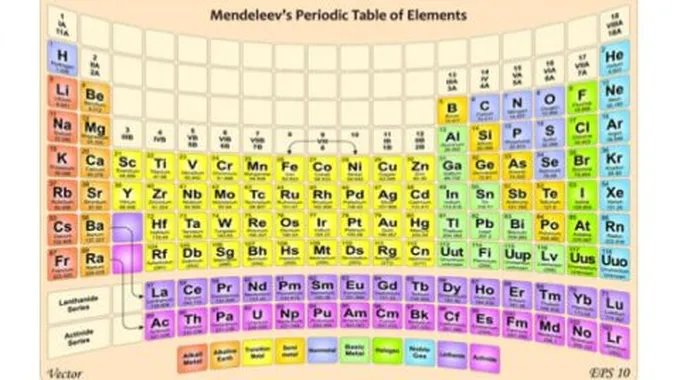
المجموعة الثانية في الجدول الدوري
يُطلَق على المجموعة الثانية من الجدول الدوري اسمَ الفلزّات القلَويّة الترابيّة (بالإنجليزيّة alkaline earth metals)، وهي عبارةٌ عن ستّة عناصرَ كيمايئّةٍ مرتّبة في سلسلةٍ رأسيّة حسب تزايدِ عددِها الذريّ، وتُعتبر هذه العناصر من العوامل المختزلة القويّة؛ إذ لها قدرةٌ على فَقْد إلكتروناتِ مدارِها الأخير بسهولة، وهي من العناصر النشطة، لذلك لا تتواجد في الطبيعة على شكل ذرّات حرّة. من أهمّ خصائص هذه المجموعة أنّها هشّة، وقابلة للطرق والسحب، وموصلةٌ للتيّار الكهربائيّ، وسريعةُ الاحتراق في الهواء الجويّ.
عناصر المجموعة الثانية من الجدول الدوريّ
البيريليوم
البيريليوم من العناصر الكيميائيّة ثنائيّة التكافؤ السامّة، وله الرمز الكيميائيّ B، وعدده الذريّ 4، ويتواجدُ في الطبيعة على هيئة فِلزّ صلب، إلا أنّه خفيف وهش، ولونه رماديّ مشابه للفولاذ، ويتميّز بقلّة كثافته ممّا جعل له كثيراً من التطبيقات العمليّة، لا سيّما في مجال الأبحاث المتعلّقة بالأشعّة والطاقة النووية، بالإضافة لاستخدامه في صناعة السبائك المختلفة، والتي لها كثيرٌ من التطبيقات الهندسيّة والتقنيّة، كما يدخل البيريليوم في تركيبِ بعض الأحجار الكريمة مثل الزمرّد الأخضر، والأزرق (البيريل)، والكريسوبيريل.
المغنيسيوم
المغنيسيوم (باللاتينية: Magnesium)، هو واحد من العناصر الكيميائيّة التي تتواجدُ بكثرة في الطبيعة، فهو يحتلّ المرتبة الثانية من حيث الوفرة، ويُشكّل ما نسبته ثلاثة بالمائة من القشرة الأرضيّة، ويحمل المغنيسيوم الرمز Mg، وعدده الذريّ 12، ويُعتبر العالم الفيزيائيّ الكيميائيّ الإسكوتلندي جوزيف بلاك أوّل من اكتشفه على شكل مركّبات موجودة في الطبيعة، وفي عام 1808 تمكّن همفري ديفي من أنْ يحصلَ على المغنيسيوم الخام من عمليّة التحليل الكهربائيّ لمركّب هيدروكسيد المغنيسيوم، إلا أنّه لم يكُنْ نقيّاً بشكل كامل؛ بسبب استخدامِه مهبطاً زئبقيّاً، وتمّ الحصول على كمّيات قليلة من المغنيسيوم النقيّ عام 1828 على يد الكيميائيّ الفرنسي أنطوان بوسي.
الكالسيوم
يحمل الكالسيوم الرمز الكيميائيّ Ca، والعددّ الذريّ 20، ويتميّز بلونه الأبيض المائل للفضيّ، ويتواجد في القشرة الأرضية بوفرة، فهو يحتلّ المرتبةَ الخامسة من حيث التواجدُ في الطبيعة، ويُعدّ من المعادن الأساسيّة التي تحتاجها الكائنات الحيّة لتقومَ خلاياها بوظائفها، وله العديد من الاستخدامات في مجالاتٍ متعدّدة أهمها استخلاص الثوريوم، واليورانيوم.
السترونشيوم
اكتشفه الإيرلنديّ أدير كراوفورد عام 1790، وهو العنصر الرابع من مجموعة الفلزّات القلويّة الترابيّة، ويحمل الرمز الكيمائيّ Sr، وعدده الذري 38. عادةً ما يتواجد السترونشيوم متّحداً مع معادن السلستست، والسترونتينيت، ويتميّز بأنّه سريعُ التفاعل مع غازات الأكسجين، والنيتروجين، والهيدروجين، وعندما يحترق يَنتُج عنه لهبٌ بلون قرمزيّ، لذلك يُستخدم في الإشارات الضوئيّة، والألعاب الناريّة الاستعراضيّة.
الباريوم
اكتشفَ عنصر الباريوم الكيميائيّ البريطانيّ همفري دايفي عام 1808م، وله الرمز Ba، والعدد الذريّ 56، وهو ذو لون أبيض فضّي، يتميّز بأنّه طريّ الملمس، وتُستخدمُ أملاحه في كثير من الصناعات مثل: الزجاج، والدهانات، والألعاب الناريّة.
الراديوم
اكتشفه الزوجان بيير وماري كوري في عام 1898، وهو من العناصر الكيميائيّة المشعّة، رمزه الكيميائيّ Ra، وعدده الذرّي 88، له لونٌ أبيضُ نقيّ، ويتميّز بسرعة تأكسده عندما يتعرّض للهواء الجويّ، فيتحوّل لونه للأسود، وعند اضمحلاله الإشعاعيّ يتصاعد منه غاز يسمى الرادون.