قانون فاراداي في التحليل الكهربائي
قانون فاراداي في التحليل الكهربائي
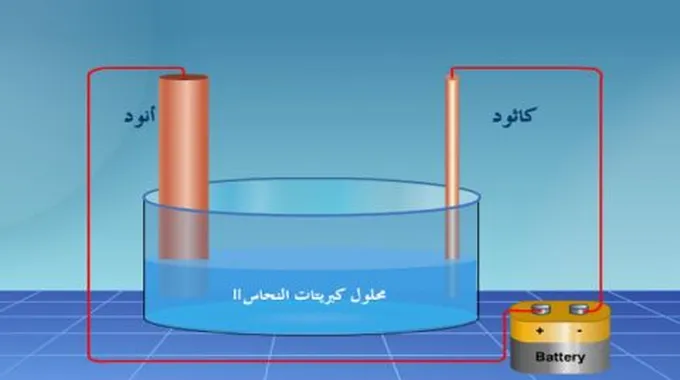
أوجد العالم مايكل فاراداي سنة 1834 قانونين فيزيائيين لخدمة التحليل الكهربائي، معتمداً على الأبحاث والتجارب الكهروكيميائية في طرق إنتاج الكهرباء، وبناءً على التغيرات الكيميائية التي تحدثها الكهرباء، ويهدف القانونان إلى توضيح العلاقة بين كتلة المادة، وبين مقدار الكهرباء التي تولدها هذه المادة.
نص قوانين فاراداي في التحليل الكهربائي
- القانون الأول في التحليل الكهربائي: تتناسب كتلة المادة المستهلكة (المتفاعلة) أو الناتجة في قطبٍ كهربائي أثناء التحليل الكهربائي، تناسباً طردياً مع كمية الكهرباء المارة في خلية التحليل، وتُقاس كمية الكھرباء (Q) بوحدة الكولوم، وھو عدد الأمبيرات (شدة التيار) المارة في وحدة الزمن.
- القانون الثاني في التحليل الكهربائي: تتناسب كتل المواد الناتجة أو المستهلكة، خلال التحليل الكهربائي، تناسباً طردياً مع كتلتها أو وزنها المكافئ عند مرور نفس كمية الكهرباء في المحلول.
الصيغة الرياضية لقوانين فاراداي:
- قانون فاراداي الأول رياضياً: (m= (Q/F)(M/Z، حيث:
- قانون فاراداي الثاني رياضياً: (m1/m2)= (Ew1/Ew2)، حيث:
- m: كتلة المادة المتفاعلة عند القطب.
- Q: كمية الشحنة الكهربائية العابرة خلال المادة، (كمية الكهرباء= شدة التيار (بوحدة الأمبير× الزمن (بوحدة الثانية).
- F ثابت فاراداي وقيمته 96500 C mol-1
- M: الكتلة المولية للمادة.
- Z: معدل نقل الإلكترونات إلى عدد الأيونات، والجدير بالذكر أن (M/Z)، هي الوزن المكافئ للمادة= (الكتلة المولية للعنصر (بوحدة الغرام)/ شحنة الأيون).
- Ew1: الوزن المكافئ للعنصر الأول.
- Ew2: الوزن المكافئ للعنصر الثاني.
تطبيقات على قانون التحليل الكهربائي
مثال (1)
مرر تيار شدته (1.5 أمبير)، في محلول كلوريد النحاس الثنائي لمدة ساعة، إذا كان وزن النحاس المترسب (1.778 غراماً)، أوجد الوزن المكافئ للنحاس؟
- الحل: من خلال تطبيق فاراداي الأول (m= (Q/F)(M/Z، ومن خلال استخدام الضرب التبادلي، الوزن المكافئ للمادة= (1.778× 96500)/ (1.5× 60× 60)= 31.77 g/eq.
مثال (2)
مرر تيار كهربائي شدته (10.4 أمبير)، لمدة 23 دقيقةً، في مصهور يوديد البوتاسيوم، احسب كتلة المواد التي تتجمع عند القطبين، علماً أنّ الكتلة الذرية لليود (127 غرام/مول)، وللبوتاسيوم (39.1 غرام/مول).
- الحل: من خلال تطبيق قانون فاراداي الأول يتمّ حساب كتلة اليود والبوتاسيوم المترسبة عند الأقطاب كالآتي:
- الكتلة المولية لليود= ((2× 127)× (10.4)× (23× 60))/ (2× 96500)= 18.89غراماً.
- الكتلة المولية للبوتاسيوم= (39.1× 10.4× 23× 60)/ (1× 96500)= 5.8 غرام.
مثال (3)
احسب الزمن اللازم لترسيب (2.16 غرام) من الفضة، عند مرور تيارٍ كهربائيّ في محلول نترات الفضة، شدته (32 أمبير)، علماً أنّ الكتلة الذرية للفضة (108 غرام/مول)؟
- الحل: كتلة الفضة المتفاعلة= (M × التيار× الزمن)/ (z× F)، إذاً الزمن اللازم= (كتلة المادة المتفاعلة× z× F)/ (التيار×الكتلة المولية)= (2.16 × 1× 96500)/ (102× 32)= 60.31 ثانية.