صيغ المركبات الأيونية
المركبات الأيونية
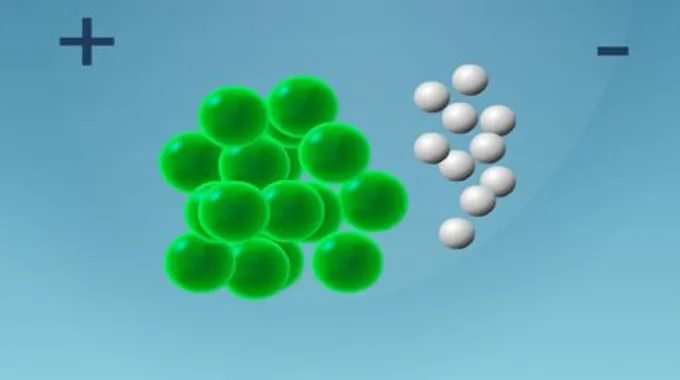
تعتبر المركبات الأيونية تجمعات للأيونات الموجبة (الكاتيونات)، والأيونات السالبة (الأنيونات) في شكل هندسي معيّن يُعرف باسم البلورة، وتترابط هذه الأيونات الموجبة والسالبة في البلورة برابطة قوية يُطلق عليها الرابطة الأيونية، والمركبات الأيونية صلبة في معظم الحالات؛ لأنّ قوى التجاذب أقوى من قوى التنافر، كما أنّها متعادلة أي شحنتها تساوي صفراً.
مميزات المركبات الأيونية
- غير موصلة للكهرباء في حال كانت صلبة على درجة حرارة الغرفة؛ بسبب قوة الترابط بين الأيونات الموجبة والسالبة.
- موصلة جيدة للكهرباء في حال إذابتها في مذيب له ثابت عزل كهربائي عالٍ يكسر الرابطة الأيونية، ويعزل الأيونات الموجبة والسالبة عن بعضها ويجعلها حرة.
- درجات غليانها وانصهارها عاليتان جداً.
- للمركبات الأيونيّة قابليّة عالية للذوبان في المذيبات القطبية.
صيغ المركبات الأيونية
طور العلماء بعض القواعد لتسمية المركبات لتسهيل عملية دراستها عن طريق استخدام نظام تسمية معياري لكتابة صيغ المركبات الأيونية، من خلال معرفة صيغة المركبات الكيميائية، وهي أبسط نسبة للأيونات في المركب الأيوني.
كتابة الصيغة الكيميائية للمركبات الأيونية
- اكتب الرمز الأيوني الموجب.
- اكتب الرمز الأيوني السالب.
- ضع أرقاماً صغيرة أسفل الرموز الأيونية للتعبير عن عدد الأيونات، وبما أنّ المركبات الأيونية لا تحمل شحنة فيجب أن يكون ناتج جمع حاصل ضرب أعداد التأكسد لكلّ أيون في الصيغة الكيميائية يساوي صفراً.
- رمز أيون الفلز يأتي قبل رمز أيون اللافلز في الصيغة الأيونية.
أمثلة حول صيغ المركبات الأيونية
الحل: رمز الأيونات: الفور F، والصوديوم Na.
- نسبة الأيونات=(F-)، و(Na+)، أي نسبة 1إلى 1.
- صيغة المركب الأيوني: NaF.
- مجموع الشحنات=صفر(-1++1= صفر).
الحل: رمز الأيونات: الأكسجين O، والبوتاسيوم K.
- نسبة الأيونات=(O--) ،(K++)، أي نسبة 2 إلى 1.
- صيغة المركب الأيوني: K2O.
- مجموع الشحنات=صفر.
الحل: رمز الأيونات: الكلور (Cl-)، والصوديوم (Na+).
- نسبة الأيونات=1 إلى 1، شحنة الكلور (-1)، وشحنة الصوديوم (+1).
- صيغة المركب الأيوني: NaCl.
- مجموع الشحنات=صفر.
الحل: رمز الأيونات: الأكسجين O، والمغنيسيوم Mg.
- نسبة الأيونات=1 إلى 1، لأن شحنة الأكسجين (-2)، وشحنة المغنيسيوم (+2).
- صيغة المركب الأيوني: MgO.
- مجموع الشحنات=صفر.
الحل: رمز الأيونات: الأكسجين O، والألمونيوم Al.
- نسبة الأيونات=2 إلى 3، لأنّ شحنة الأكسجين (-2)، وشحنة الألمونيوم (+3).
- صيغة المركب الأيوني=Al2O3.
- مجموع الشحنات=صفر، حيث إنّ (2(Al+3) تلغي شحنة 3(O-2))،(2×(+3)=+6)،(3×(-2)=-6)،(+6)+(-6)=صفر.