ضغط الغازات
الحالة الغازيّة
توجدُ المادّة في الطبيعة في أربعِ حالات فيزيائيّة، وهي: الحالة الغازيّة، والحالة السائلة، والحالة الصلبة، وحالة البلازما. وفي موضوعنا سنتحدّثُ عن الحالة الغازية للمواد بإيجاز. فالحالة الغازيّة للمادة هي حالة وسطيّة بين الحالة السائلة وحالة البلازما. وتوجد الغازات في الطبيعة إمّا نقيّة مثاليّة، أوغازات حقيقيّة.
خصائص الغازات
- الروابط بين جزيئاتها تكون ضعيفة جداً، بسبب وجود مسافةٍ كبيرةٍ بين الجزيئات.
- تتحرّك الجزيئات بطريقةٍ عشوائية غير منتظمة.
- الطاقة الحركيّة للجزيئات كبيرة.
- كثافة الغازات قليلة.
- عامل الضغط للغازات كبيرٌ مقارنةً بالحالة الصلبة والسائلة؛ بسبب وجود المسافة الكبيرة بين الجزيئات.
العوامل المؤثّرة في ضغط الغازات
- درجة الحرارة: من المعروف أن التدريج العالمي لقياس درجة الحرارة هو تدريجٌ مطلق أي يبدأ من الصفرالمطلق، والذي يُعرف بتدريج كالفنّ، كما يوجد التدريج الفهرنهايتيّ، وتدريج السيليسيوس. تتناسب كثافة الغازات طرديا من ازدياد درجة الحرارة، حيث تزيد كثافة الغاز كلما زادت درجة الحرارة.
- الحجم: يُعرّف حجم أي مادة بأنه الحيّز الذي تشغلُه المادة، وحجم الغازهو حجم الوعاء الموجود فيه.
- الضغط الجويّ: الضغط الجوي هو عبارة عن الضغط الذي يحمل عمود زئبق ارتفاعه 760 ملليمتراً عند درجة حرارة صفر سيليسيوس عند مستوى سطح البحر.
- عدد المولات.
قوانين الغازات
وُضعتْ قوانين الغازات لتصف العلاقة بين عامل الحرارة وحجم الغازات والضغط، ويوجد ثلاثة قوانين للغازات، هي:
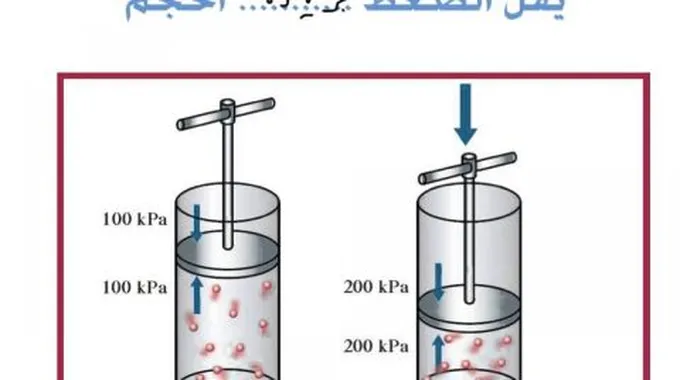
- قانون بويل(Boyl’s law): وضعه العالم روبرت بويل في 1662م، يصف هذا القانون العلاقة بين الضغط والحجم عند الغازات، بشرط ثبات درجة الحرارة، فكلما زاد الضغط على عيّنة من الغاز قل الحجم (العلاقة عكسيّة).
- قانون شارل(Charle’s law): وضعه العالم شارل في عام 1787م، يصف العلاقة بين درجة الحرارة وحجم الغاز، بوجود شرط ثبات الضغط، فكلما زادت درجة الحرارة زاد حجم العينة من الغاز (العلاقة طرديّة).
- قانون غاي- لوساك: وضع في عام 1809م، يصفُ العلاقة بين الضغط ودرجة الحرارة، مع وجود شرط ثباتِ الحجم، فكلّما زادت درجة الحرارة زاد ضغط الغاز (العلاقة طرديّة).
طريقة قياس الغازات
يمكنُ قياس ضغط الغازات الصغيرة باستخدام جهاز المانومتر، بحيث لا يتعدّى الضغط الجوي له واحداً من الضغط الجوي. يتكون جهاز المانومتر من أنبوب على شكل حرف U ، حيث تتصل إحدى طرفيه بالوعاء الذي نريد قياس ضغط الغاز فيه، والطرف الآخر يتصل بالجو. يوضعُ زئبق داخل الأنبوب حتّى يصل إلى نصف ارتفاع كلٍّ من الطرفين، ويكون ضغط الغاز المراد قياس ضغطه هوعبارة عن الفرق بين ارتفاع الزئبق في طرفيْ الأنبوب مع إضافة الضغط الجويّ.
بالنسبة لقياس ضغط الغازات الكبيرة أو العالية فيكون باستخدام صفيحة معدنيّة رقيقة، حيثُ تتمدّد بتأثير من ضغط الغاز، والذي ينتج عنه تحرّكٌ للمؤشّر على لوحة مدرّجة، وهذا التدريج تمتّ معايرته لضغوط الغازات العالية.