كيف احسب العدد الذري
حساب العدد الذري
يُمكن إيجاد العدد الذري لأي عنصر من خلال الجدول الدوري، حيث يُكتب تحت رمز العنصر، ولكن في الحالات التي تكون فيها الذرة متعادلةً أو مستقرةً، فإنّ عددها الذري يكون مساوٍ لعدد البروتونات ذات الشحنة الموجبة، ولعدد الإلكترونات ذات الشحنات السالبة، أيّ أنّ العدد الذري يُساوي عدد البروتونات ويُساوي عدد الإلكترونات، وبذلك فإن صافي الشحنة للذرة يساوي صفر.[1]
العدد الذري في الجدول الدوري
قام العالم الكيميائي الروسي ديمتري مندليف عام 1869 بترتيب عناصر الجدول الدوري، وذلك بالاعتماد على السلوك الدوري للخصائص الكيميائيّة للعناصر، وبناءً على ترتيب الكُتلة الذريّة النسبيّّة لكلّ عنصر والتي يُشار إليها بالرمز Ar، وتُعرَف عادةً بالوزن الذري، ولم تكن فكرة الذرات التي تتكوّن من جُزيئات أصغر من الذرة مثل البروتون معروفةً بعد في ذلك الوقت، ولكن بعد وفاة العالم مندليف عام 1907، لم يتمكّن العلماء من قياس العدد الذري، وعرفوا خصائص العناصر حسب موقعها في التسلسل الكُلّي للجدول الدوري فقط، وفي عام 1913، أي بعد وفاة العالم مندليف بست سنوات، قام العالم الكيميائي هنري موزلي بإعادة ترتيب العناصر تِبعاً لعددها الذري، أي عدد البروتونات في كلّ عنصر، وذلك من خلال معرفة طول موجة الأشعة السينيّة للعناصر التي تمّ تصنيفها كعناصر صلبة في الجدول الدوري، وتمكَّن من معرفة ذلك عن طريق تعريضها مباشرةً لشعاع من الإلكترونات، باستخدام جهاز بات يُعرف الآن باسم مدفع الإلكترونات، وبالتالي أصبحت عمليّة قياس العدد الذري أكثر وضوحاً.[2]
العدد الذري
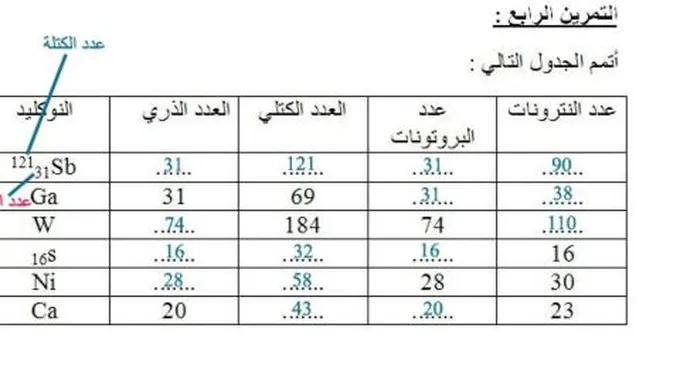
يُشير العدد الذري إلى عدد البروتونات التي تتواجد داخل نواة الذرّة،[3]حيث يُشار لعدد البروتونات في النواة بالرمز Z، وتُعتبر البروتونات هي المسؤولة عن تحديد صفات وخصائص العناصر المُختلفة، أمّا عدد النيوترونات، فيُشار إليه بالرمز N، وتُساوي الكتلة الذريّة للنواة مجموع عدد النيوترونات والبروتونات، وتتكوّن الذرّة من نواة ذات شحنة كهربائيّة موجبة، وإلكترونات ذات شحنة سالبة.[1]
المراجع
- ^ أ ب "Nuclear Structure", www2.lbl.gov, Retrieved 30-7-2018. Edited.
- ↑ "Ordering the elements in the Periodic Table", www.rsc.org, Retrieved 30-7-2018. Edited.
- ↑ "Atomic Number and Mass", www.galileo.phys.virginia.edu, Retrieved 30-7-2018. Edited.