بحث عن عدد أفوجادرو
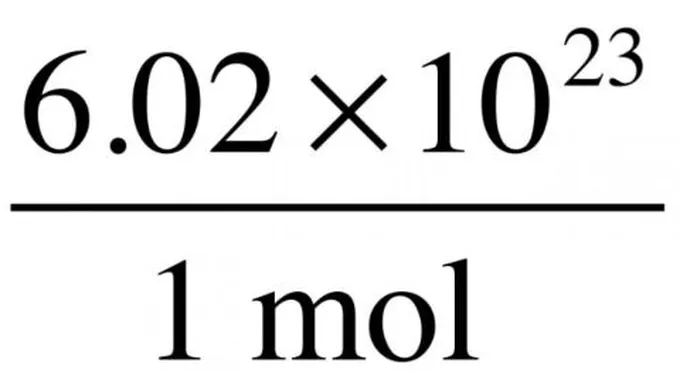
عدد أفوجادرو
يُعبّر مفهوم عدد أفوجادرو عن عدد الوحدات الموجودة في المول الواحد وهو الوزن الجزيئيّ في الغرام الواحد من أي مادّة، ويُساوي (23*10^6.022140857)، أمّا الوحدات فهي تختلف بحسب طبيعة المادّة وخصائص التّفاعل فقد تكون إلكترونات، أو ذرّات، أو أيونات، أو جزيئات[1]
تاريخ عدد أفوجادرو
نفى العالم الكيميائيّ جورج إم بودنز من جامعة بودرو الاعتقاد السائد بين النّاس وهو أنّ أماديو أفوجادرو هو مُكتشف عدد أفوجادرو، وأشار إلى أنّ أفوجادرو كان محاميّاً ثمّ اهتم بعلم الرياضيّات والفيزياء وفي علم 1820 أصبح أوّل أستاذاً للفيزياء في دولة إيطاليا، وكانت فرضيّته التي توضّح أنّ الكميّات المتساوية للغازات المختلفة والتي تمتلك نفس درجة الحرارة والضغط تحتوي على نفس عدد الجسميات، هي الأكثر شهرةً.[2]
كان معلّم المدرسة الثانويّة النمساويّ جوزيف لوشميت والذي أصبح لاحقاً أستاذاً في جامعة فينا هو أوّل شخص اكتشف العدد الفعليّ للجسيمات في كميّة محددة من مادّة محددة، حيث استخدم النظريّة الحركيّة للجزيئات لتحديد عدد الجسميات في سنتمتراً مربعّاً واحدة من الغاز في الظروف القياسيّة، وتُعرف الكميّة التي اكتشفها بثابت لوشميت، حيث أنّ القيمة المقبولة له هي (2.6867773*10^25 م^-3).[2]
أمّا مفهوم عدد أفوجادرو فقد استُخدم لأوّل مرّة من قِبل الفيزيائيّ الفرنسي جين بيرين، ففي علم 1909 حيث وضع العالم تقديراً لعدد أفوجادرو نسبةً لعمله في الحركة البراونيّة وهي الحركة العشوائيّة للجزيئات المجهريّة الموجودة في غازاً أو سائلاً، ثمّ تمّ استخدام التقنيّات المتعددة لتحديد قيمة عدد أفوجادرو في السنوات اللاحقة.[2]
يجب قياس الكميّة الواحدة على كل من المقياس الذريّ والمجهريّ وباستخدام نفس الوحدات القياسيّة للتمكّن من تحديد القيمة الدقيقة لعدد أفوجادرو، وأصبح أمر القياس ممكناً للأوّل مرّة عندما قاس الفيزيائيّ الأمريكيّ روبرت ميليكان شحنة الإلكترون، حيث تمّ تحديد قيمة شحنة المول الواحد من الإلكترونات وأُطلق على هذا الثابت اسم فاراداي، والمقدار الأدق لهذا الثابت ثابت بالنسبة إلى الجمعيّة الوطنيّة للمعايير والتكنولوجيا هو (96.485.3383) كولومبس في المول الواحد، أمّا المقدار الأدقّ لشحنة الإلكترون وفقاً للتجارب العلميّة الحديثة هو (10^-19*1.60217653) كولومبس للإلكترون الواحد، ويُمكن تحديد عدد أفوجادرو عن طريق تقسيم شحنة مول واحد من الإلكترونات على شحنة إلكترون واحد حيث يُساوي (23 ^10*6.02214154).[2]
يُمكن قياس عدد أفوجادرو باستخدام طريقة أخرى، وهي القياس الدقيق لكثافة عيّنة من مادّة عالية النقاء بحسب المقياس المجهريّ أوّلاً، ثمّ قياس هذه العيّنة بحسب المقياس الذريّ باستخدام تقنيّة انحراف الأشعّة السينيّة للتمكّن من تحديد عدد الذّرات لكل خليّة في البلورة والمسافة بين النقاط المتقابلة.[2]
قانون أفوجادرو
كما ذُكر سابقاً فإنّ قانون أفوجادرو يعبّر عن القاعدة المُكتشفة من قِبل أميدو أفوجادرو وهو أستاذ الفيزياء المتقدّمة في جامعة تورين التي اكتشفها في عام 1811م، ولكن اعتُمدت في عام 1858م عندما قام عالم الكيمياء الإيطالي ستانيسلو كانزارو بإنشاء نظاماً كيميائيّاً يعتمد عليها حيث تنص هذه القاعدة على أنّ الغازات متساوية الأحجام الواقعة ضمن نفس ظروف الضغط ودرجة الحرارة تحمل نفس عدد الجزيئات، واعتمدت هذه النظريّة على نظرية حركة الغازات باستخدام الغاز المثاليّ، ويُمكن اعتبار هذا القانون صالحاً للغازات الحقيقيّة في الظروف المحتوية على ضغطٍ منخفضٍ بشكلٍ كبير ودرجة حرارة مرتفعة، حيث تستخدم عدد أفوجادرو لحساب عدد الجزيئات في الجرام الواحد للمول في المادّة.[3]
مثال على استخدام عدد أفوجادرو في الكيمياء
يُستخدم عدد أفوجادرو في الكيمياء عند الحاجة للتعامل مع أرقاماً ضخمة، وذلك لأنّه الأساس لوحدة المول في القياس، حيث أنّه يسهّل عمليّة التحويل بين المولات، والكتل، وعدد الجزيئات، فعلى سبيل المثال يمكن استخدام عدد أفوجادرو لحساب عدد جزيئات الماء في قطعة ثلج واحدة.[4]
مثال:
كم عدد جزيئات الماء الموجودة في قطعة من الثلج وزنها 1 ميلي غرام؟[4]
الحل:
- الخطوة الأولى: يجب حساب كتلة الماء الموجودة في المول الواحد. لاستخراج كتلة الماء في المول الواحد يجب معرفة العدد الكتليّ لكل من الهيدروجين والأكسجين باستخدام الجدول الدوريّ وذلك لأنّ الثلج مصنوعاً من الماء أو H2O بحسب الصيغة الكيميائيّة لها، وباستخدام هذه الصيغة يمكن الاستنتاج بأنّ هناك ذرتان من الهيدروجين وذرّة واحدة من الأكسجين في المحلول، ولذلك فإنّ كتلة الماء هي ما يلي:
- كتلة الماء: 2 * كتلة الهيدروجين + كتلة الأكسجين.
- كتلة الماء: 2 * (1.01 غرام) + 16.00 غرام.
- كتلة الماء : 2.02 غرام + 16.00 غرام.
- كتلة الماء: 18.02 غرام.
- الخطوة الثانية: يجب حساب عدد الجزيئات الموجودة في غراماً واحدة من الماء. يجب العلم بإنّ المول الواحد من الماء يحتوي على (6.022 * 10^23) من الجزئيات؛ وذلك بحسب قاعدة عدد أفوجادرو، وسيتم استخدام هذه العلاقة لتحويل عدد جزيئات الماء إلى غرامات، في العلاقة الآتية: كتلة الماء في س من الجزيئات مقسومة على س من الجزيئات = كتلة المول الواحد من جزيئات الماء مقسومة على عدد أفوجادرو. ولحل السؤال نقوم بالخطوات الآتية:
- إضافة القيم إلى المعادلة السابقة مع إعادة ترتيبها لتصبح: عدد جزيئات الماء س = (6.022 * 10^23 من جزيئات الماء)/(18.02 غرام * 1 غرام س جزيئات الماء) = 3.35 * 10^22 جزئيات/غرام.
- يوجد 3.35 * 10^22 من جزيئات الماء في الغرام الواحد.
- بما أنّ قطعة الثلج تزن 1 ميلي غرام، والغرام الواحد يساوي 1000 ميلي غرام، فإنّ ( عدد جزيئات الماء س) = 3.35 * 10^22 جزيئات/الغرام * (1 غرام/ 1000 ميلي غرام) = (3.35 * 10^19 جزيئات/ميلي غرام).
- الإجابة هي: يوجد 3.35 * 10^19 جزيئات/ميلي غرام في قطعة الثلج التي تزن 1 ميلي غرام.[4]
المراجع
- ↑ "Avogadro’s number", www.britannica.com, Retrieved 15-10-12017. Edited.
- ^ أ ب ت ث ج "How was Avogadro's number determined?", www.scientificamerican.com, Retrieved 15-10-2017. Edited.
- ↑ "Avogadro’s law", www.britannica.com, Retrieved 15-10-2017. Edited.
- ^ أ ب ت Anne Marie Helmenstine, Ph.D. (4-11-2016), "Avogadro's Number Example Chemistry Problem - Water in a Snowflake"، www.thoughtco.com, Retrieved 15-10-2017. Edited.