خصائص الجدول الدوري
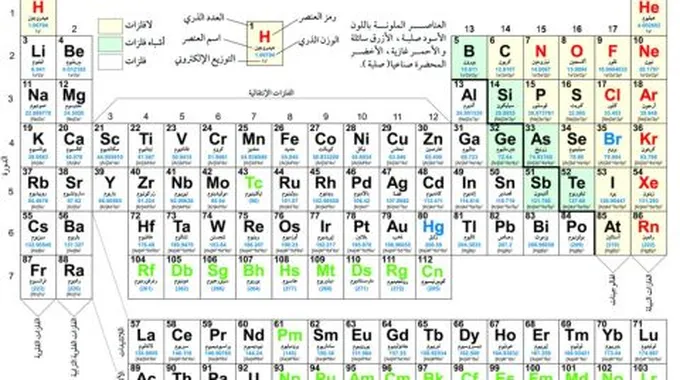
الجدول الدوري
الجدول الدوري، أو جدول مندليف، هو عبارة عن جدول يحتوي على العناصر الكيميائيّة التي تم اكتشافها، حيث تم ترتيب هذه العناصر، وفق الزيادة في أعدادها الذرية، كما تم ترتيب العناصر المتشابهة في الخصائص، في نفس الصف أو العمود، لذلك فهو يعتبر أهم الأدوات الّتي يتم استخدامها في الكيمياء بشكل خاص، وفي العلوم بشكل عام.[1]
أهميّة الجدول الدوري
أهميّة الجدول الدوري:[2]
- تحديد موقع العنصر في الدورة أو المجموعة.
- معرفة البنية الإلكترونيّة لذرّة العنصر.
- معرفة سلوك العنصر الكيميائي.
- التنبؤ بالتفاعلات الكيميائية، الّتي يستطيع العنصر أن يدخل فيها.
خصائص الجدول الدوري
خصائص الجدول الدوري :[3]
- يوجد في الجدول الدوري 118 عنصر، ولا زال البحث قائماً عن ابتكار وإيجاد عناصر جديدة.
- معظم العناصر في الجدول الدوري عبارة عن معادن، وهي المعادن القلوية، والمعادن القلوية الترابية، والمعادن الأساسيّة، والمعادن الانتقاليّة.
- يحتوي الجدول الدوري على سبع دورات أفقيّة.
- يحتوي على 18 مجموعة (الأعمدة الرّأسية).
- يطلق على اسم صفوف الجدول الدوري (الدور)، ويكون رقم عنصر الدور، عبارة عن أعلى مستوى طاقة، للإلكترونات غير المهيّجة.
- يعتمد الجدول الدوري في تصنيف العناصر، على الزيادة في أعدادها الذرية، حيث يقل حجم الذرة، عند الانتقال من اليسار إلى اليمين في الدورة الواحدة، كما يزداد عند الانتقال من أعلى إلى أسفل المجموعة الواحدة.
- عناصر المجموعة الواحدة متشابهة في الخصائص، ولها نفس ترتيب إلكترونات المدار الأخير.
- عناصر المجموعة الأولى والثانية والثالثة، تميل لفقد الإلكترونات، وتصبح أكثر كهروجابية.
- عناصر المجموعة الرابعة والخامسة والسادسة، تميل لكسب الإلكترونات، وتصبح أكثر كهروسلبية.
- تنتهي كل دورة في الجدول الدوري، بعنصر خامل (نبيل)، يتميّز بأنّ إلكترونات مداره الأخير ممتلئة.
- إلكترونات التكافؤ، أو إلكترونات المدار الأخير للعنصر، تحدد رقم الدورة الّتي ينتمي إليها.
- تقع في أسفل الجدول الدوري سلسلتان طويلتان من العناصر، تسمى السلسلة الأولى لانثانيدات والسلسلة الثانية أكتنيدات، وتحتوي كل سلسلة على 14 عنصراً، وتنتمي هذه السلاسل إلى مجموعة العناصر الانتقالية، وقد وضعت في أسفل الجدول الدوري، لتوفير الحيز.
- تصنّف العناصر في الجدول الدوري إلى فلزات ولا فلزات، يقسم بينهما أشباه الفلزات.
- تقل الكهروسلبية كلما انتقلنا من يمين إلى يسار العناصر في الجدول الدوري.
يستعمل الجدول الدوري في المدارس والجامعات، وفي الأبحاث العلميّة، للاستدلال على صفات العناصر الكيميائية والفيزيائية، حيث يسهل على الطلاب وعلى طلبة العمل والباحثين، استنتاج النتائج، من خلال تقييم حالة عنصر ما، ولا زال العلماء حتى وقتنا هذا في صدد اكتشاف عناصر جديدة، لإضافتها للعناصر الحاليّة.[3]
المراجع
- ↑ Tim Sharp (28-8-2017), "Periodic Table of Elements "، /www.livescience.com, Retrieved 8-7-2018. Edited.
- ↑ Wanda Thibodeaux (26-4-2018), "The Importance of a Periodic Table "، sciencing.com, Retrieved 8-7-2018. Edited.
- ^ أ ب Anne Marie Helmenstine, Ph.D. (31-1-2018), "Why Is the Periodic Table Important?"، www.thoughtco.com/, Retrieved 8-7-2018. Edited.