عدد العناصر في الجدول الدوري
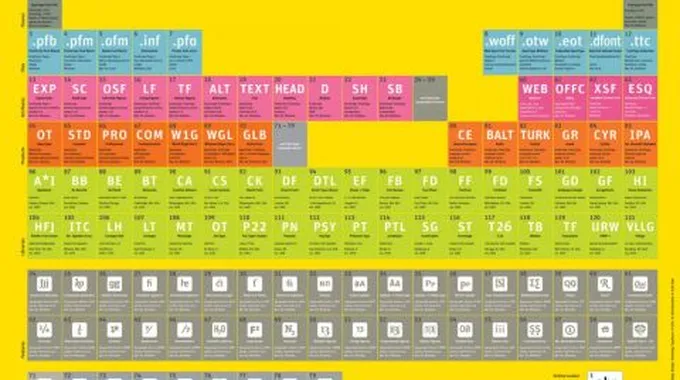
الجدول الدوري
يمكن تعريف الجدول الدوري للعناصر بأنّه ترتيب للعناصر الكيميائية على شكل جدول مكوّن من صفوف وأعمدة، يطلق على الأعمدة منها اسم المجموعات ويبلغ عددها الكلي ثماني عشرة مجموعة، ويطلق على الصفوف اسم الدورات ويبلغ عددها الكلي سبع دورات، بالإضافة إلى سلسلتين يُطلق على الأولى منها اسم اللانثانيدات، وعلى الأخرى اسم الأكتينيدات.
تأسيس الجدول الدوري
يرجع هذا الجدول في تصنيفه وترتيبه إلى الكيميائي الروسي ديمتري مندليف الذي اعتمد في ترتيب جدوله على تزايد الكتلة الذرية للعناصر، وذلك في عام 1869م، ويعد هذ الجدول الأساس للجدول الدوري الحديث، وكان عدد العناصر المكوّنة له في وقتها ستة وستين عنصراً فقط، وفي عام 1911م عدل الكيميائي هنري موزلي ترتيب العناصر في الجدول، ليعتمد في ترتيبها على العدد الذري وهو عدد البرتونات وهي الجسيمات الموجبة في الذرة والمساوي لعدد الالكترونات وهي الجسيمات السالبة في الذرة.
عدد عناصر الجدول الدوري
للجدول الدوري العديد من الاستخدامات في مجالات العلوم المختلفة، وتنقسم المجموعات التي تمثل الأعمدة فيه إلى قسمين هما المجموعات الثمانية الرئيسية (الممثلة) A وهي: المعادن القلوية التي تحتوي على إلكترون في مدارها الأخير، والمعادن القلوية الترابية، والمعادن الضعيفة، وأشباه المعادن، واللامعادن، والهالوجينات، والغازات النبيلة وهي المجموعة الأخيرة وتحتوي على ثمانية إلكترونات في مدارها الأخير، والقسم الآخر هو المجموعات العشرة الفرعية (الانتقالية) B.
يبلغ العدد الكلي للعناصر في الجدول الدوري 118 عنصراً، وقد تمت إضافة الأربعة الأخيرة منها حديثاً في عام 2016م، وهذه العناصر هي: أنون تريوم، وأنون بنتيوم، وأنون سيبتيوم، و أنون أكتيوم، وهي تحمل الأرقام 113، 115، 117، 118 في الجدول الدوري، وتتوفر العناصر المرقمة من 1-98 في الجدول الدوري في الطبيعة، بينما تعد العناصر المرقمة من 99-118 عناصر صناعية لا توجد في الطبيعة إنما تُصنع فقط في المختبر، وقد أعطى العلماء كلّ عنصر من العناصر في الجدول الدوري رمزاً يمثل عادة الحرف الاول من اسم العنصر باللغة الإنجليزية، وفي حالة اشتراك عنصرين بالحرف ذاته يضاف عادة الحرف الثاني من اسم أحدهما إلى الحرف الأول.
خصائص الجدول الدوري
تحتوي عناصر المجموعة الواحدة على العدد نفسه من إلكترونات التكافؤ: وهي الإلكترونات الموجودة في الغلاف الخارجي، وتتشابه عناصر المجموعة الواحدة في الخصائص العامة، ويزداد عدد هذه الإلكترونات كلما انتقلنا نحو اليمين في الجدول الدوري، وتحتوي عناصر الدورة الواحدة من الجدول الدوري على العدد ذاته من الأغلفة التي تحتلها الإلكترونات عند التوزيع الالكتروني.
تقع العناصر المعدنية يسار الجدول الدوري الحديث، وهي عبارة عن عناصر صلبة في معظمها -عدا الزئبق- على درجات الحرارة العادية، بالإضافة إلى تمتعها بالبريق المعدني، وقابليتها العالية للطرق والسحب، وتوصيلها الجيد للكهرباء والحرارة، وتقع العناصر اللامعدنية يمين الجدول الدوري، وهي عبارة عن عناصر درجات انصهارها منخفضة، وضعيفة التوصيل الكهربائي والحراري، وهي تتنوع في طبيعتها بين الطبيعة الغازية والسائلة والصلبة.