مم تتكون الذرة
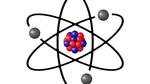
الذرةتُعرَّف الذرة (بالإنجليزيّة: Atom) بأنها أصغر وحدة في المادة، والتي تمتلك الخصائص المميزة للعناصر الكيميائية، وهي وحدة البناء الأساسية في الكيمياء، والتي
الذرة
تُعرَّف الذرة (بالإنجليزيّة: Atom) بأنها أصغر وحدة في المادة، والتي تمتلك الخصائص المميزة للعناصر الكيميائية، وهي وحدة البناء الأساسية في الكيمياء، والتي تعدّ أصغر وحدة يُمكن تقسيم المادة إليها دون تحرير جسيمات مشحونة كهربائياً،[1] وقد مرّ اكتشاف الذرة في العديد من المراحل، إذ ترجع نظرية الذرة إلى العالم والفيلسوف اليوناني ديموقريطس في العام 440 قبل الميلادي، والذي اقترح أنّ المادة تصل إلى نقطة لا يمكن بعدها تجزئتها، وهي الذرات، والتي تكون قادرة على الحركة، والتجمع لتكوين مواد جديدة، وقد خالفه بذلك غالبية الفلاسفة، ومن ضمنهم أرسطو الذي كان يؤمن بأن كل المواد قد تكونت من الأرض، والنار، والهواء، والماء.[2]
تتالت النظريات التي تعلقت بالذرة فيما بعد، فقد جاء الكيميائي البريطاني جون دالتون بنظريته الخاصة في العام 1803م بالاعتماد على أفكار ديموقريطس، إذ اعتقد بأنّ الذرات في العنصر الواحد تكون متشابهةً، وتختلف ذرات العناصر فيما بينها في الخصائص والوزن، كما أن المادة عبارة عن اندماج الذرات، والتي لا يمكن تدميرها أو استحداثها، بينما أثبت الفيزيائي البريطاني طومسون أنه يمكن تقسيم الذرة، واستطاع تحديد الجسيمات السالبة الشحنة، وقد بنى للذرة نموذجاً فيما بعد يمثلها على أنها كرة موجبة تشبه الكعكة المستديرة والتي تنتشر فيها الإلكترونات كما تنتشر حبات الزبيب في الفطائر، ثم قدم العالم رذرفورد نموذجه الذري في العام 1911م، والذي اقترح فيه أن الإلكترونات تدور حوال النواة موجبة الشحنة، وأن مساحة الذرة تتكون معظمها من الفراغ، كما تعاقب على النموذج الذري العديد من العلماء الآخرين كشرودنغر، وفيرنر هايزنبيرغ، وموراي جيل مان، وجورج زويغ.[2]
مكونات الذرة
البروتونات
تعدّ البروتونات (بالإنجليزيّة: Protons) إحدى الجسيمات الرئيسية التي تتكون منها الذرة، والتي تمتلك شحنةً كهربائية موجبة واحدة (+1)، وكتلةً تساوي وحدة كتلة ذرية واحدة amu، أو ما يعادل 1.67x10-27 كيلوغرام تقريباً، وتوجد البروتونات في نواة الذرة، والتي تعدّ مركزها، وتشكّل مع النيوترونات كتلة الذرة كاملةً تقريباً.[3]
النيوترونات
تحتوي جميع ذرات العناصر باستثناء غالبية ذرات الهيدروجين على نيوترونات (بالإنجليزيّة: Neutrons) في أنويتها، والتي لا تحمل أي شحنات كهربائية، مما يجعلها متعادلة، وتمتلك هذه النيوترونات كتلةً أكبر قليلاً من كتلة البروتونات، وقطراً يساوي قطر البروتونات تقريباً.[3]
الإلكترونات
تتكون جميع الذرات من إلكترونات يساوي عددها عدد البروتونات الموجودة فيها، وتحمل هذه الإلكترونات الشحنة السالبة، فكل إلكترون يمتلك وحدة واحدة من الشحنة السالبة، والتي تلغي شحنة البروتون الموجب، مما يجعل الذرة متعادلةً كهربائياً، وتحمل الإلكترونات كتلةً أقل بكثير من كتلة البروتونات والنيوترونات، والتي تساوي 31-10*9.10938 كيلوغرام، وتوجد الإلكترونات خارج النواة على عكس البروتونات والنيوترونات، إذ تتحرك على شكل جسيمات تدور حول النواة، وقد تم اقتراح مصطلح الإلكترون أول مرة في العام 1891م من قبل العالم ستوني، ولكنه اكتُشف في العام 1897م من قبل الفيزيائي البريطاني طومسون.[3][4]
حقائق تتعلق بمكونات الذرة
هناك العديد من الحقائق التي تتعلق بمكونات الذرات، ومنها ما يأتي:[5]
- تتشكل الروابط الكيميائية نتيجة مشاركة أو نقل الإلكترونات بين الذرات المختلفة، كما تستخدم هذه الإلكترونات في العديد من التطبيقات كأنابيب أشعة كاثود، والأنابيب المفرغة، وليزر الإلكترون الحر.
- تتطابق الإلكترونات مع بعضها البعض في ميكانيكا الكم، إذ لا يوجد أي خاصية فيزيائية ذاتية يمكن استخدامها للتميز بين الإلكترونات، مما يجعل من تبادلها أمراً ممكناً دون إحداث أي تغيير ملاحظ.
- تعد الإلكترونات إحدى الجسيمات الأولية التي تنتمي إلى عائلة اللبتون (بالإنجليزيّة: lepton family).
- يمكن أن تتواجد الإلكترونات بشكل حر في الفراغ.
- ينتج عن حركة الإلكترونات أو البروتونات مجالاً مغناطيسياً.
- يمتلك الإلكترون زخماً زاوياً دورانياً يساوي 2/1.
- يعود أصل كلمة الإلكترون لليونانيين القدامى.
- تبلغ كتلة البروتون حوالي 1840 ضعف كتلة الإلكترون.[6]
- تتكون البروتونات من جسيمات أولية تسمى كوارك (بالإنجليزيّة: quark).[6]
- افترض العالم ارنست رذرفورد وجود النواة في العام 1911م لتفسير تجاربه في تشتت جسيمات ألفا، كما اكتشف البروتونات عام 1919م كناتج لتفكك النواة الذرية.[6]
- تمّ اكتشاف النيوترون من قبل جيمس تشادويك في العام 1932م، والذي يعدّ اكتشافاً مركزياً مهدّ الطريق لمجال الفيزياء النووية فيما بعد.[7]
- تتوزع الإلكترونات في مستويات عدة للطاقة، وذلك بالاعتماد على كمية الطاقة التي تملكها، ومدى قربها من النواة، ويطلق على مستوى الطاقة الأقرب للنواة اسم المستوى الأول للطاقة، بينما يشار إلى المستوى الذي يليه بالمستوى الثاني للطاقة، وهكذا، ويرمز إلى مستوى الطاقة بالرمز n.[8]
- يتكون كل مستوى من مدار واحد أو أكثر، وللمدارات أربعة أنواع مختلفة، وهي (s, p, d, f).[8]
الخصائص الأساسية للذرات
هناك العديد من الخصائص التي تتعلق بالذرات، ومنها ما يأتي:[1]
- العدد الذري: يعدّ العدد الذري السمة الأهم في الذرة، والذي يساوي عدد وحدات الشحنة الموجبة في النواة (عدد البروتونات)، ويشار إليه بالرمز Z، ويحدّد العدد الذري الخصائص الكيميائية للعناصر المختلفة، إذ يساوي عدد البروتونات في الذرة المتعادلة عدد الإلكترونات فيها، والتي تحدد كيفية تفاعل الذرة مع الذرات الأخرى.
- الكتلة الذرية والنظائر: لا يؤثر عدد النيوترونات الموجودة في الذرة على الخصائص الكيميائية لها، فمثلاً تحمل الذرات المحتوية على 6 بروتونات، و6 نيوترونات نفس الخصائص الكيميائية التي تمتلكها الذرات التي تحتوي على 6 بروتونات و 8 نيوترونات، وتعرف الذرات التي تحمل نفس عدد البروتونات بأعداد مختلفة من النيوترونات بالنظائر، حيث تمتلك جميع العناصر الكيميائية العديد من النظائر، بينما يؤثر عدد النيوترونات على كتلة الذرات التي تساوي مجموع كتلة النواة وكتلة الإلكترونات، والتي تقاس بوحدة الكتلة الذرية للعنصر المساوية لكتلة 12/1 من كتلة الكربون 12.
المراجع
- ^ أ ب Sharon McGrayne, George Bertsch, James Trefil, "Atom"، www.britannica.com, Retrieved 2018-12-9. Edited.
- ^ أ ب Tim Sharp (2017-8-8), "What is an Atom?"، www.livescience.com, Retrieved 2018-12-9. Edited.
- ^ أ ب ت "The Properties of Protons, Neutrons, and Electrons", www.chem.libretexts.org, Retrieved 2018-12-9. Edited.
- ↑ Anne Helmenstine (2018-1-3), "Electron Definition - Chemistry Glossary"، www.thoughtco.com, Retrieved 2018-12-9. Edited.
- ↑ Anne Helmenstine (2018-1-3), "Electron Definition - Chemistry Glossary"، www.thoughtco.com, Retrieved 2018-12-9. Edited.
- ^ أ ب ت "Proton", www.encyclopedia.com, Retrieved 2018-12-9. Edited.
- ↑ "Neutron, Discovery Of", www.encyclopedia.com, Retrieved 2018-12-9. Edited.
- ^ أ ب "Electron Configuration: Orbital, Noble-Gas & Electron-Configuration Notation", www.study.com, Retrieved 2018-12-9. Edited.
المقال السابق: كيف أحافظ على صديقي
المقال التالي: محافظة قنا في الصعيد
مم تتكون الذرة: رأيكم يهمنا
0.0 / 5
0 تقييم
