تحليل الماء كهربائياً
مفهوم تحليل الماء كهربائياًبدأ العلماء بالبحث عن مصادر أخرى للطاقة؛ نتيجة قلة مصادر الطاقة غير المتجددة، وارتفاع أسعارها، ويُعدّ الهيدروجين مصدراً مثالياً
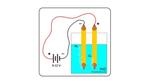
مفهوم تحليل الماء كهربائياً
بدأ العلماء بالبحث عن مصادر أخرى للطاقة؛ نتيجة قلة مصادر الطاقة غير المتجددة، وارتفاع أسعارها، ويُعدّ الهيدروجين مصدراً مثالياً للطاقة؛ حيث إنّه لا يسبب تلوث الهواء عند احتراقه، لكن تكمن المشكلة في كيفية إنتاج الهيدروجين، ومن الطرق التي تساعد على إنتاج الهيدروجين هي تحليل الماء كهربائياً، ولا تزال هذه الطريقة في مرحلة البحث، إلا أنّها أظهرت نتائج مثالية لإمكانية استخدامها في المستقبل.[1]
ينتج من التحليل الكهربائي للماء غازا الهيدروجين والأكسجين، وتتكون خلايا التحليل الكهربائي من زوجين من أقطاب البلاتينيوم مغمورة في الماء، إضافة إلى كمية قليلة من مادة كهرلية (Electrolyte) مثل (H2SO4)، وهذه المادة مهمة؛ لأنّ الماء النقي يحتوي على كميات قليلة من الأيونات، وتتمّ هذه العملية كالآتي:[1]
يتأكسد الماء عند المصعد (Anode) إلى غاز الأكسجين، وأيونات الهيدروجين، ويُختزل الماء عند المهبط (Cathode) إلى غاز الهيدروجين، وأيونات الهيدروكسيد، كما في المعادلات الآتية:[1]
-2H2O → O2 + 4H+ + 4e (المصعد، تأكسد)
2H2O + 2e- → 2OH- + H2 (المهبط، اختزال)
2H2O → 2H2 + O2 (التفاعل الكلي)
ملاحظات:[1]
- قيمة جهد الاختزال (Eْ) للمصعد يساوي (1.23V-)، وللمهبط يساوي (0.83V-)، وبالتالي فإنّ جهد الاختزال الكلي للتفاعل يساوي (2.06V-).
- تمّ ضرب معادلة المهبط بالرقم 2؛ من أجل معادلة عدد الإلكترونات.
- المادة الكهرلية (H2SO4) لم تُستهلك خلال التفاعل.
- أيونا الهيدروجين والهيدروكسيد اللذان تكوّنا في تفاعلي المصعد والمهبط تفاعلا لينتج الماء كما يظهر في معادلة التفاعل الكلي.
تأثير رفع درجة الحرارة في التحليل الكهربائي
يُفضّل رفع درجة الحرارة خلال عملية التحليل الكهربائي للماء للأسباب الآتية:[2]
- تقليل كمية الطاقة الكهربائية المستهلكة.
- زيادة موصلية الأيونات الخاصة بالمادة الكهرلية.
- زيادة سرعة التفاعلات الكيميائية على أسطح الأقطاب الكهربائية.
طرق أخرى لإنتاج غاز الهيدروجين
يُعدّ غاز الهيدروجين من أهمّ المصادر البديلة للطاقة، وهناك عدة طرق لإنتاجه -بالإضافة إلى التحليل الكهربائي للماء- ومنها:[3]
إعادة تكرير الغاز الطبيعي
(بالإنجليزية: Natural Gas Reforming)، حيث يتمّ من خلال هذه الطريقة إنتاج الهيدروجين من الغاز الطبيعي باستخدام درجة حرارة عالية من البخار، وهناك طريقة أخرى يتمّ فيها أكسدة غاز الميثان أكسدة جزئية من خلال حرقه في الهواء، ومن خلال هاتين الطريقتين ينتج غاز يعرف بـ (Synthesis Gas) الذي يتفاعل مع كمية إضافية من البخار لتنتج كميات عالية من غاز الهيدروجين.
طرق بيولوجية
تقوم بعض أنواع الميكروبات مثل الطحالب الخضراء، وبعض أنواع البكتيريا بإنتاج الهيدروجين؛ وذلك بتحليل الماء بوجود أشعة الشمس، وهناك بعض الميكروبات تقوم باستخلاص الهيدروجين مباشرة من الكائنات الحية.
المراجع
- ^ أ ب ت ث "Electrolysis of Water", chem.libretexts.org,1-8-2016، Retrieved 14-2-2019. Edited.
- ↑ Md Mamoon Rashid, Mohammed K. Al Mesfer, Hamid Naseem, Mohd Danish (2-2015), "Hydrogen Production by Water Electrolysis: A Review of Alkaline Water Electrolysis, PEM Water Electrolysis and High Temperature Water Electrolysis"، www.researchgate.net, Retrieved 14-2-2019 (page 88). Edited.
- ↑ "Hydrogen Production", www.energy.gov,9-2014 ، Retrieved 14-2-2019 (page 1-2). Edited.
المقال السابق: أطباق مكرونة سريعة
المقال التالي: حلويات بالشوكولاتة سهلة التحضير
تحليل الماء كهربائياً: رأيكم يهمنا
0.0 / 5
0 تقييم
