ضغط الغاز
حالات المادةإنّ للمادّة ثلاث حالات وهي الحالة الصلبة، والحالة السائلة، والحالة الغازية، ولكلٍّ منها خصائص تُميّزها عن غيرها؛ ففي الحالة الصلبة تكون المادة ذات
حالات المادة
إنّ للمادّة ثلاث حالات وهي الحالة الصلبة، والحالة السائلة، والحالة الغازية، ولكلٍّ منها خصائص تُميّزها عن غيرها؛ ففي الحالة الصلبة تكون المادة ذات شكلٍ ثابت وحجم ثابت، وذلك لأنّ قوى التجاذب بين جزيئات المادة الصلبة كبيرة، وتختلف هذه القوى من مادة إلى أخرى. أما الحالة السائلة فإنها ذات حجم ثابت وشكل متغير، حيث إنّها تأخذ شكل الوعاء الذي توضع فيه، وذلك لأنّ قوى التجاذب بين جزيئات المادة السائلة متوسطة، مما يجعلها قادرةً على الجريان.
تتميّز الحالة الغازية بتغيّر شكلها وحجمها؛ إذ إنّ قوى التجاذب بين جزيئاتها ضعيفة جداً، حيث تأخذ شكل الوعاء الذي توضع فيه، ويعتمد حجمها على الحيّز الذي توضع فيه، وهي تمتاز بقدرتها على الانتشار.
الضغط
يُعرف الضغط بأنّه القوّة العمودية المؤثرة على السطح، ويقاس بعدة وحدات منها؛ وحدة الباسكال، حيث يساوي الباسكال نيوتن/ م²، كما تستخدم العديد من الأجهزة لقياس الضغط؛ مثل الباروميتر المستخدم في قياس الضغط الجوي، حيث يوجد بنوعين؛ وهما الباروميتر الفلزي، والباروميتر الزئبقي.
إنّ الضغط الجوي فهو وزن عمود الهواء الممتد من سطح الأرض حتى نهاية الغلاف الجوي المؤثر في وحدة المساحة، أمّا ضغط الغاز فهو الضغط الذي يولّده الغاز المحصور في الوعاء على جدرانه، نتيجة القوّة المؤثرة فيه، الناتجة عن الحركة السريعة والعشوائية لجُزيئات الغاز في جميع الاتجاهات.
العلاقة بين درجة حرارة الغاز وضغطه
هناك علاقة بين درجة حرارة الغاز وضغطه عند ثبات حجمه؛ حيث إنّ جزيئات الغاز المحصورة تستمرّ في الحركة، وتتصادم مع بعضها البعض ممّا يؤدّي لتولد ضغط على جدران الوعاء الموجودة فيه، فإذا كان الوعاء ثابت الحجم، وارتفعت درجة حرارة الغاز داخله فإنّ الغاز سيولّد ضغطاً على جدران الوعاء، وسيحدث العكس إذا برد الغاز حيث يقل ضغطه؛ إذ إنّ قانون غاي لوساك يصف هذه العلاقة الطردية رياضياً: ( P1/T1=P2/T2)
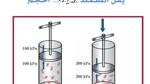
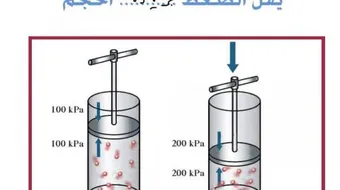
العلاقة بين ضغط الغاز وحجمه
إن قانون بويل يصف العلاقة العكسيّة بين ضغط الغاز وحجمه عند ثبات درجة حرارته، حيث يُعبّر عنه رياضياً بالتالي:(P1V1= P2V2)؛ إذ إنّ P تمثل ضغط الغاز، و V تمثل حجمه.
العلاقة بين حجم الغاز ودرجة حرارته
ثمة علاقة بين حجم الغاز ودرجة حرارته عند ثبات ضغطه؛ حيث يزداد حجم الغاز بزيادة درجة حرارته؛ وذلك لأنّ جزيئات الغاز تكتسب كميّةً من الحرارة تجعلها تتباعد عن بعضها، ممّا يؤدي إلى زيادة حجمها؛ إذ إنّ قانون شارل يصف هذه العلاقة الطردية رياضياً: (V1/T1= V2/T2)، ويمكن جمع القوانين الثلاث السابقة بقانون واحد: (P1V1/T1= P2V2/T2 )
المقال السابق: كيف أعرف أني وقعت في الحب
المقال التالي: كيف تكون بشرتك صافية
ضغط الغاز: رأيكم يهمنا
0.0 / 5
0 تقييم
